آیا بیماری های خودایمنی قابل درمان هستند؟

آیا بیماری های خودایمنی قابل درمان هستند؟ در سال 2001، ایمونولوژیست پر سانتاماریا در حال بررسی راه جدیدی برای مطالعه دیابت بود. او و همکارانش با کار روی موش، روشی را توسعه دادند که از نانوذرات اکسید آهن برای ردیابی سلولهای ایمنی کلیدی درگیر در این اختلال استفاده میکند.
اما سپس سانتاماریا، که در دانشگاه کلگری در کانادا است، ایده جسورانه ای را مطرح کرد. شاید او بتواند از این ذرات به عنوان درمانی برای هدف قرار دادن و خاموش کردن یا حتی کشتن سلولهای مسئول بیماری استفاده کند – سلولهایی که سلولهای جزایر تولیدکننده انسولین را در پانکراس از بین میبرند.
این یک ایده دور از ذهن به نظر می رسید، اما او تصمیم گرفت آن را امتحان کند. او میگوید: «به انجام آزمایشهای آزمایشی ادامه دادم. اکنون، بیش از دو دهه بعد، درمان سانتاماریا در آستانه آزمایش در افراد است.
این تنها نیست. محققان بیش از 50 سال است که در تلاش بوده اند تا سلول هایی را که مسئول اختلالات خود ایمنی مانند دیابت نوع 1، لوپوس و مولتیپل اسکلروزیس هستند رام کنند.
اکثر درمان های تایید شده برای این شرایط با سرکوب کل پاسخ ایمنی کار می کنند. این اغلب علائم را کاهش می دهد، اما افراد را در معرض خطر ابتلا به عفونت و سرطان قرار می دهد.
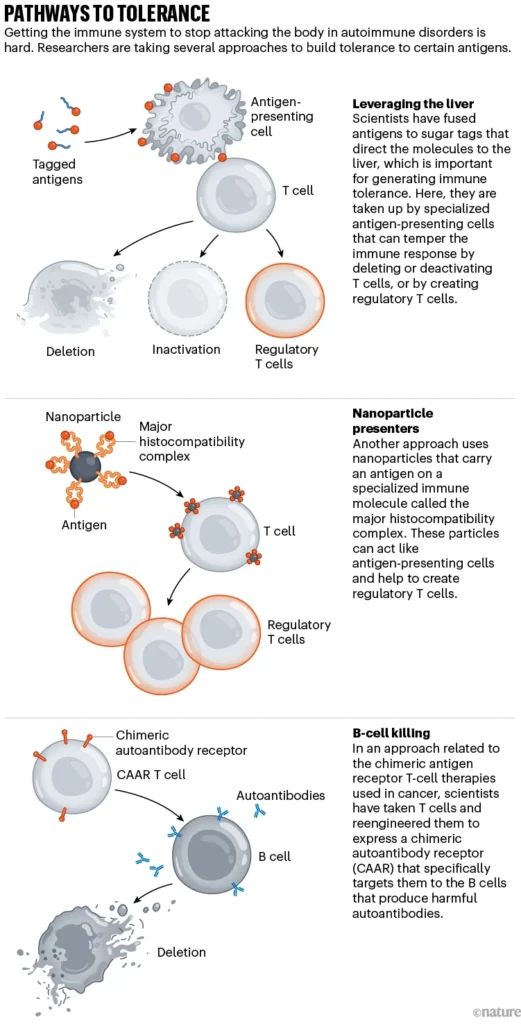
اما برای دههها، ایمونولوژیستها امیدوار بودند آنچه را که به عنوان تحمل شناخته میشود بازگردانند – توانایی سیستم ایمنی برای نادیده گرفتن آنتیژنهای متعلق به بدن در حالی که به طور مناسب به آنهایی که ندارند حمله میکنند.
در برخی موارد، این به معنای تجویز همان آنتی ژن هایی است که سلول های سرکش برای حمله به آنها آموزش دیده اند، استراتژی ای که می تواند سلول ها را برنامه ریزی کند و پاسخ خود ایمنی را کاهش دهد.
سایر محققان در تلاشند تا به طور انتخابی سلول های مشکل ساز را از بین ببرند یا سلول های ایمنی سرکوب کننده ای را معرفی کنند که برای هدف قرار دادن آنها مهندسی شده اند.
یک رویکرد که بر سلول های ایمنی مهندسی شده تکیه دارد برای درمان 15 نفر مبتلا به لوپوس یا سایر اختلالات ایمنی با موفقیت شگفت انگیزی استفاده شد . یک شرکت کننده بیش از دو سال و نیم بدون علامت بوده است.
ماکسیمیلیان کونیگ، روماتولوژیست دانشگاه جانز هاپکینز در بالتیمور مریلند، متخصص در اختلالات خودایمنی، میگوید: اگر آزمایشهای بیشتر روی افراد نتایج مثبت نشان دهد، میتواند زندگی را تغییر دهد.
او می گوید: «درمان هایی که ما برای این بیماری ها داریم وحشتناک است. آنها همیشه کار نمی کنند، و حتی زمانی که کار می کنند، بهبود اغلب کم است. کونیگ میگوید صحبت در مورد درمانهایی که میتوانند درمان را فراهم کنند، «تقریباً کفرگویی» است.
اکنون، با رسیدن برخی از نتایج، درمان های درمانی ممکن به نظر می رسد. “تنها سوال این است که بهترین رویکرد چیست؟” او می پرسد.
آیا بیماری های خودایمنی قابل درمان هستند؟
خودآگاهی
سیستم ایمنی به دلیل نقشش در حمله به پاتوژن ها شناخته شده است. اما کار دیگری هم دارد که به همان اندازه مهم است: دانستن اینکه چه زمانی باید کناره گیری کرد. اگر سلولهای ایمنی بافتهای بدن را بهعنوان یک تهدید ببینند، میتوانند باعث آسیب شوند.
بازوی سیستم ایمنی درگیر در حملات هدفمند شامل سلولهایی به نام لنفوسیت است که برای تشکیل سلولهای T که معمولاً سلولهای خارجی یا بیمار را شناسایی کرده و به آنها حمله میکنند، و سلولهای B که آنتیبادی تولید میکنند و به روشهای دیگر از سیستم ایمنی حمایت میکنند، تمایز پیدا میکنند.
این سلولها در ابتدای رشد خود تحت فرآیندی قرار میگیرند تا سلولهایی را که بافتهای بدن را هدف قرار میدهند، از بین ببرند.
جفری هابل، مهندس شیمی در دانشگاه شیکاگو در ایلینویز میگوید، اما این فرآیند که به عنوان تحمل مرکزی شناخته میشود، «نشتی» است. برخی از سلول ها از بین می روند.
بدن دارای یک سیستم پشتیبان است، مکانیزمی که به عنوان تحمل محیطی شناخته می شود.
این سلولهای بیطرف را از بین میبرد یا غیرفعال میکند یا آنها را به سلولهای T تنظیمی تبدیل میکند که با جلوگیری از حمله سلولهای دیگر، پاسخ ایمنی را سرکوب میکنند.
در بیماری های خودایمنی، هم تحمل مرکزی و هم تحمل محیطی به دلایلی که کاملاً مشخص نیست، از بین می روند و سیستم ایمنی شروع به حمله به آنتی ژن های موجود در سلول ها و بافت های بدن می کند.
در مولتیپل اسکلروزیس ، بدن به غلاف میلین که اعصاب را عایق می کند، حمله می کند. در بیماری سلیاک، گلوتن سیستم ایمنی را تحریک می کند تا به پوشش روده حمله کند.
اگر دانشمندان بتوانند سلولهای ناکارآمد را آرام کرده یا از بین ببرند – بازگرداندن تحمل به آنتیژنهای خاص – میتوانند این بیماری را بدون مختل کردن توانایی سیستم ایمنی در واکنش به تهدیدات واقعی درمان کنند.
تلاش های اولیه بر روی تجویز مقادیر زیادی از آنتی ژن مشکل ساز در تلاش برای تخلیه یا غیرفعال کردن سلول های ایمنی که آن را تشخیص می دهند متمرکز بود.
گروه های زیادی این شکل از حساسیت زدایی را با سطوح مختلف موفقیت امتحان کرده اند.
جفری بلوستون، ایمونولوژیست و مدیر اجرایی و یکی از بنیانگذاران Sonoma Biotherapeutics در سانفرانسیسکوی جنوبی، کالیفرنیا، می گوید: آنتی ژن باید به روش درست معرفی شود تا تحمل را به جای فعال کردن ایمنی افزایش دهد. “این کل زمینه درمان آنتی ژن خاص است.”
آیا بیماری های خودایمنی قابل درمان هستند؟
چرخاندن سوئیچ
انتخاب آنتی ژن مناسب مشکل است. برخی از بیماری های خودایمنی تنها در اثر واکنش به یک مورد ایجاد می شوند.
اما برای بسیاری از شرایط – مولتیپل اسکلروزیس، دیابت و آرتریت روماتوئید، برای نام بردن چند مورد – بدن از طریق پدیده ای به نام گسترش اپی توپ در برابر چندین آنتی ژن پاسخ ایمنی ایجاد می کند.
بلوستون می گوید که محققان می توانند سعی کنند تمام آنتی ژن های درگیر را بررسی کنند. اما این یک دستور بلند است، به خصوص به این دلیل که لیست ممکن است از فردی به فرد دیگر متفاوت باشد.
امکان دیگر جستجوی کلید اصلی است که با چرخاندن آن، پاسخ خودایمنی را خاموش می کند و در عین حال سیستم ایمنی را دست نخورده باقی می گذارد.
سانتاماریا فکر می کند که چنین مکانیزمی را پیدا کرده است. نانوذرات تیم او – که او آنها را ناواسیم می نامد – با پروتئین هایی به نام مولکول های پیچیده سازگاری بافتی تزئین شده اند که مانند سنبله از سطح ذره بیرون می زند.
این سنبلهها به منظور تقلید از سلولهای تنظیمکننده سیستم ایمنی به نام سلولهای ارائهدهنده آنتیژن هستند که آنتیژنها را در سراسر بدن پاک میکنند و سپس آنها را به سلولهای T میبرند و به سلولها میگویند که آیا آنها را مورد حمله قرار دهند یا نادیده بگیرند. ‘). سانتاماریا آنها را به طعمه سلول T تشبیه می کند.
پس از اینکه سانتاماریا کشف کرد که چگونه از Navacim ها برای ردیابی سلول های T استفاده کند، شروع به کار کرد که چگونه از آنها به عنوان یک درمان استفاده کند. او مشکوک بود که نانوذرات ممکن است باعث مرگ یا خاموش شدن سلول ها شوند.
در آن زمان، سانتاماریا با مدل موش دیابت نوع 1 کار می کرد، بیماری که در آن گسترش اپی توپ مشخص است.
بنابراین، او کوکتلی از ذرات حاوی هشت قطعه آنتی ژن مختلف یا اپی توپ تولید کرد. برای کنترل، او از نانوذره ای استفاده کرد که حامل یک اپی توپ منفرد بود و حدس زد که هیچ اثری نخواهد داشت زیرا سلول های T هزاران اپی توپ را در دیابت تشخیص می دهند.
با این حال، با کمال تعجب، هم نانوذرات کنترل و هم نانوذرات تجربی علائم دیابت را معکوس کردند. سانتاماریا میگوید: «این کاملاً معنی نداشت.
سالها طول کشید تا بفهمد چه اتفاقی در حال رخ دادن است، اما اکنون فکر می کند که را می فهمد . نانوذرات سلولهای T را تحریک میکنند تا تکثیر شوند و به سلولهای T تنظیمکننده تبدیل شوند که به محل التهاب میروند.
در آنجا سلولهای ارائهدهنده آنتیژن را که نه تنها آنتیژنی را که این سلولها تشخیص میدهند، بلکه هزاران آنتیژن دیگر را که در دیابت مهم هستند، حمل میکنند، متصل و غیرفعال میکنند. بنابراین این سلولها دیگر نمیتوانند سلولهای ایمنی را که به بیماری سوخت میکنند، فعال کنند.
به یک معنا، آنتی ژن ذوب شده با نانوذرات به عنوان یک کلید اصلی عمل می کند. سانتاماریا میگوید: «گاهی اوقات خیلی خوب به نظر میرسد که درست باشد.
و ممکن است باشد. این استراتژی هنوز در کلینیک آزمایش نشده است. سانتاماریا شرکتی به نام Parvus Therapeutics در جنوب سانفرانسیسکو تاسیس کرده است.
این باید اولین آزمایش خود را در سال جاری در افراد آغاز کند، که با یک بیماری خودایمنی که کبد را تحت تاثیر قرار می دهد شروع شود.
آیا بیماری های خودایمنی قابل درمان هستند؟
یک کلید در کبد
کبد جایی است که تمام خون حامل آنتی ژن های خارجی از روده فیلتر می شود. همچنین مقصد تمام بقایای سلولی است که پس از مرگ سلولها و بافتها باقی میمانند.
بنابراین نقش مهمی در ایجاد تحمل ایمنی دارد. هابل و همکارانش دریافتند که پسماندهای سلولی دارای برچسب قند خاصی هستند که آن را به سمت کبد هدایت می کند.
با افزودن این برچسب قند به پروتئین های دیگر، آنها متوجه شدند که می توانند تقریباً هر مولکولی را که می خواهند به کبد هدایت کنند، از جمله آنتی ژن هایی مانند پروتئین های میلین که سیستم ایمنی را در مولتیپل اسکلروزیس فعال می کنند.
در کاری که در سال 2023 منتشر شد، آنها نشان دادند که این استراتژی برای معکوس کردن علائم بیماری مشابه مولتیپل اسکلروزیس در موش ها عمل می کند .
هابل میگوید آنچه در مورد این مقاله بسیار هیجانانگیز بود، این بود که حیوانات بیماری پیشرفته داشتند، به این معنی که سیستم ایمنی آنها احتمالاً در برابر انواع آنتیژنها واکنش نشان میداد.
با این حال، درمان تنها با یک آنتی ژن در معکوس کردن فلج موثر بود.
شرکتی به نام Anokion در کمبریج، ماساچوست، که Hubbell یکی از بنیانگذاران آن است، روی استراتژی مشابهی کار می کند.
آن را در یک کارآزمایی فاز I در افراد مبتلا به مولتیپل اسکلروزیس برای ارزیابی ایمنی آن آزمایش کرده است و در حال حاضر در حال ثبت نام شرکت کنندگان در کارآزمایی فاز دوم است که در آن شروع به ارزیابی اثربخشی می کند.
مدیر اجرایی این شرکت، دبورا گراتی، دقیقاً نمیگوید که درمان پس از رسیدن آنتی ژن به کبد چگونه عمل میکند.
او میگوید: «ما بسیاری از آنها را بهصورت عمومی فاش نکردهایم، اما او اضافه میکند، «ما معتقدیم که یک مؤلفه نظارتی قوی T را هدایت میکنیم.»
بلو استون روی رویکرد متفاوتی تصمیم گرفته است. او و همکارانش در Sonoma Biotherapeutics سلولهای T را از خون بیماران میگیرند، سلولهای تنظیمکننده را استخراج میکنند و آنها را مهندسی میکنند تا آنتیژنی را بیان کنند که سلولهای T تنظیمکننده را هنگام تزریق مجدد به محل بیماری هدایت میکند.
در آنجا، آنها باید بتوانند تمام سلول های T عصبانی اطراف را آرام کنند، نه فقط آنهایی که آنتی ژن خاصی را که حمل می کنند تشخیص می دهند.
Sonoma سلولهای T تنظیمکننده را در آزمایشهای بالینی آزمایش کرده است، اما سلولهایی را که برای بیان یک آنتیژن خاص مهندسی شدهاند، آزمایش نکردهاند.
این شرکت قصد دارد اولین دوز را در اوایل سال 2024 به فرد مبتلا به آرتریت روماتوئید بدهد.
بلوستون فکر میکند که این رویکرد نسبت به مصرف آنتیژنهایی که ممکن است خودایمنی را بیشتر تشدید کند، خطر کمتری دارد.
و سلول های T تنظیمی فاکتورهای ترمیم کننده بافت را تولید می کنند که ممکن است به معکوس کردن برخی از آسیب های ناشی از بیماری کمک کند.
اما درمان های سلولی با چالش هایی از جمله هزینه بالا و عوارض جانبی بالقوه همراه هستند. بلوستون می گوید: «اینها داروهای زنده هستند.
چگونه دوز را برای سلول هایی که پس از تزریق، شروع به تکثیر در بدن می کنند تعیین می کنید؟ “هنوز چیزهای زیادی وجود دارد که باید یاد بگیریم.”
آیا بیماری های خودایمنی قابل درمان هستند؟
سلول های B در کانون توجه
در حالی که محققانی مانند Bluestone و Hubbell در حال تلاش برای تحریک سیستم ایمنی به سمت تحمل هستند، دیگران در حال توسعه درمان هایی هستند تا مستقیماً سلول های ایمنی را که در ایجاد بیماری نقش دارند از بین ببرند.
یک تیم در آلمان رویکردی را امتحان میکند که معمولاً برای درمان سرطان خون استفاده میشود که سلولهای T را به چیزی که به عنوان گیرنده آنتی ژن کایمریک (CAR) شناخته میشود، مجهز میکند.
پزشکان سلول های T را از بدن بیمار می گیرند و آنها را مهندسی می کنند تا این گیرنده مصنوعی تخصصی را بر روی سطح خود بیان کنند.
آنها می توانند یک CAR ایجاد کنند که به CD-19، پروتئینی که در تمام سلول های B یافت می شود، متصل می شود. سپس پزشکان سلول های CAR T را به بدن تزریق می کنند، جایی که آنها شروع به حمله به سلول های B می کنند.
تاکنون محققان نتایجی را برای 15 نفر ارائه کرده اند : 8 نفر مبتلا به لوپوس. 4 با اسکلروز سیستمیک، که بافت همبند را تحت تاثیر قرار می دهد. و 3 با میوزیت التهابی ایدیوپاتیک که باعث التهاب و ضعف عضلانی می شود. علائم افراد به طور چشمگیری بهبود یافت.
اما شگفتانگیزترین چیز این است که همه آنها حتی پس از شروع به تولید سلولهای B جدید در بهبودی باقی ماندهاند. گویی از بین بردن سلول های B باعث بازنشانی سیستم ایمنی بدن می شود .
لارنس استاینمن، متخصص عصبی در دانشگاه استنفورد در کالیفرنیا، که بسیاری او را پدر درمان اختصاصی آنتی ژن مینامند، میگوید: «نتایج شگفتانگیز، حیرتانگیز و فوقالعاده هستند». اولین شرکت کننده در این مطالعه که مبتلا به لوپوس بود، در ماه دسامبر از مرز 1000 روز گذشت و هیچ نشانه ای از بیماری نداشت.
کونیگ موافق است که نتایج “باورنکردنی” هستند: “بیشتر مردم درجه دوام را پیش بینی نمی کردند.” اما او می افزاید: «فکر نمی کنم بتوانیم انتظار داشته باشیم که این بیماری برای همیشه در هر بیمار ناپدید شود.» سلول های T که به تحریک لوپوس کمک می کنند هنوز وجود دارند.
درمانهای CAR-T تمام سلولهای B را هدف قرار داده و از بین میبرند، که ممکن است در نظر گرفتن این رویکرد راهی برای بازگرداندن تحمل شود.
اما برای بیشتر بیماری های خودایمنی، تنها بخش کوچکی از سلول های B مشکل ساز هستند. ایمی پین، متخصص پوست در کالج پزشکان و جراحان واگلوس دانشگاه کلمبیا در شهر نیویورک، میخواست راهی برای هدف قرار دادن این سلولها بیابد.
او یک بیماری پوستی نادر به نام پمفیگوس ولگاریس مخاطی را مطالعه می کند. در افراد مبتلا به این بیماری، سیستم ایمنی آنتیبادیهایی را علیه پروتئینی در پوست به نام دسموگلئین 3 میسازد.
سلولها از هم میپاشند و تاولهایی در سراسر مخاط [و] روی پوست ایجاد میشود.»
درمان استاندارد پمفیگوس، یک آنتی بادی مونوکلونال، با از بین بردن سلول های B عمل می کند.
با از بین رفتن سلول های B، آنتی بادی های ضد دسموگلئین 3 ناپدید می شوند و افراد بهبود می یابند. پین میگوید: «درمانهای فعلی ما واقعاً یک سلاح بینقص هستند.
پین متوجه شد که ممکن است با تغییر رویکرد CAR-T بتواند سلاح متمرکزتری تولید کند. به جای مهندسی کردن یک گیرنده سلول T که به تمام سلولهای B متصل میشود، او میتواند سلولهای T را برای بیان پروتئین دسموگلین 3 مهندسی کند، که به آنتیبادیهای دسموگلین 3 که از سطح سلولهای B سرکش میچسبد متصل میشود . این درمان به عنوان CAAR (گیرنده اتوآنتی بادی کایمریک) سلول T شناخته می شود.
او میگوید: «مثل لیزر است که سلولهای B خود را که باعث بیماری میشوند را هدف قرار میدهد، اما سلولهای B سالم را به حال خود رها میکند.»
پین شرکتی به نام Cabaletta Bio را در فیلادلفیا، پنسیلوانیا تأسیس کرد و در حال حاضر در حال آزمایش این سلول ها در افراد مبتلا به پمفیگوس و بیماری خودایمنی دیگری به نام میاستنی گراویس است که باعث ضعف عضلانی می شود.
پین می گوید، سلول های B به عنوان یک هدف امیدوارکننده در بسیاری از بیماری های خودایمنی ظاهر می شوند. در برخی از شایع ترین اختلالات، سلول های B نقش پیچیده ای دارند.
آنها نه تنها آنتی بادی تولید می کنند، بلکه سیگنال هایی را نیز منتشر می کنند که باعث التهاب و ارائه آنتی ژن به سلول های T می شود و به شعله ور شدن شعله هایی که بیماری های خود ایمنی را روشن نگه می دارند، کمک می کند.
پین میگوید: در ایمونولوژی، «همه روی سلولهای T تمرکز میکردند زیرا سلولهای باهوش بودند و سلولهای B درست مثل پسر عموی بیچاره بودند»، اما «شاید سلولهای B واقعاً مانند کلید باشند».
استینمن مراقب است که خیلی خوشبین نباشد. او چندین دهه روی رویکردهایی در جهت تحمل ایمنی سرمایه گذاری کرده است.
او میگوید: «هر بار که اینها به کلینیک برده میشوند، از جمله برخی از تلاشهای خودم، از دریافت تأییدیه دارو کوتاهی میکنند. در این مرحله، او میافزاید: «من میخواهم شرطهایم را پرچین کنم.»
سانتاماریا پیشنهاد میکند که بسیاری از شکستهای گذشته ناشی از درک ضعیف مکانیسمهای اساسی است.
او میگوید: «من فکر میکنم آنها شکست میخورند، زیرا قبل از اینکه ما واقعاً بدانیم داریم چه کار میکنیم، به آزمایش بالینی میروند.
اکنون، 18 سال از تحقیقاتش در مورد Navacim ها می گذرد، او فکر می کند که تیمش شانس خوبی برای موفقیت دارد.
کونیگ از رویکردهایی که شامل تخلیه سلول های B هستند، طرفداری می کند. این استراتژی ای است که تیم او روی آن کار می کند، بنابراین او می پذیرد که ممکن است مغرضانه باشد.
“زیبایی این است که در نهایت از داده ها خواهیم آموخت که رویکرد درست چیست.”
Nature 625 ، 646-648 (2024)
doi: https://doi.org/10.1038/d41586-024-00169-7